Agar mengetahui cara atom-atom dapat
berikatan, kamu harus mempelajari susunan elektron di dalam suatu atom atau
yang disebut konfigurasi elektron. Sebagaimana dijelaskan pada model atom Bohr,
elektron bergerak mengelilingi inti atom menurut tingkat-tingkat energi
tertentu yang disebut sebagai kulit-kulit atom. Tingkat energi dalam suatu atom
berturut-turut dilambangkan dengan K untuk kulit atom pertama (n=1), L untuk
kulit atom kedua (n=2), M untuk kulit atom ke tiga (n=3), dan seterusnya.
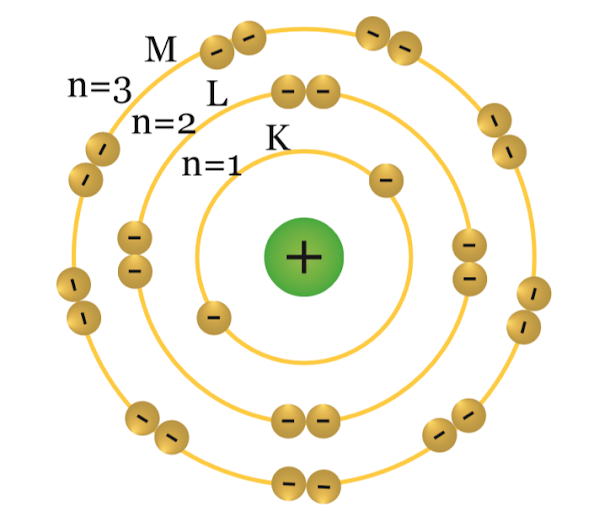 |
| Gambar Kulit-Kulit Atom dan Jumlah Elektron Maksimal yang Dapat Menempati Kulit Tersebut |
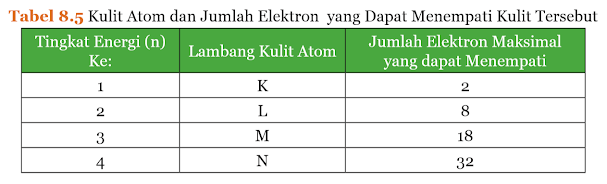
Berdasarkan Tabel 8.5, perhatikan jumlah elektron pada tiap-tiap kulit beberapa atom berikut.
Posisi elektron secara berurutan dimulai dari kulit K, kemudian ke kulit atom yang lebih tinggi. Pada contoh di atas, atom helium (He), natrium (Na), dan klor (Cl), mempunyai konfigurasi electron sesuai dengan urutan jumlah elektron yang dapat menempati kulit K, L, dan M.
Pada atom Ca yang mempunyai 20 elektron,
kulit atom K dan L berturut-turut ditempati oleh 2 dan 8 elektron sehingga
tersisa 10 elektron. Walaupun kulit M dapat ditempati 18 elektron, tetapi
jumlah elektron yang tersisa hanya 10, maka sebanyak 8 elektron akan menempati
kulit M terlebih dahulu dan 2 elektron akan menempati kulit N. Hal ini
disebabkan penempatan 8 elektron pada kulit M dan 2 elektron pada kulit N lebih
stabil dibandingkan penempatan 10 elektron sekaligus pada kulit M. Apabila
jumlah elektron yang tersisa setelah K dan L lebih dari 18 elektron maka kulit
atom M akan ditempati 18 elektron. Perhatikan contoh konfigurasi atom bromin
dan kripton. Intinya, elektron akan berada pada setiap kulit hingga membentuk
susunan yang paling stabil.
Referensi:
Ilmu Pengetahuan Alam. SMP/MTs Kelas IX Semester 2. Kementerian Pendidikan dan Kebudayaan. Edisi Revisi Jakarta: Kementerian Pendidikan dan Kebudayaan, 2017
Baca juga:
Partikel Penyusun Benda dan Makhluk Hidup | |
01 | |
02 | |
03 | Mengidentifikasi Perbedaan Zat dalam Benda dan Makhluk Hidup |
04 | |
05 | |
06 | |
07 | |
08 | |
09 | |
10 | |
11 | |
12 | |
13 | |
14 | |
15 | |
16 | |
17 | Sifat Zat dan Hubungannya dengan Partikel Penyusun dan Strukturnya |
18 | |
19 | |
20 | |


Tidak ada komentar:
Posting Komentar