Masih ingatkah kamu dengan materi tentang
unsur? Unsur merupakan zat murni yang tidak dapat
diubah lagi menjadi zat lain dengan reaksi kimia, seperti emas, besi, perak,
oksigen, dan masih banyak yang lain. Saat ini ada sekitar 105 unsur yang
ditemukan di alam, lihat sistem periodik unsur pada Lampiran di bawah.
Masing-masing unsur memiliki karakteristik yang berbeda-beda.
Atom-atom dari unsur yang berbeda memiliki jumlah partikel subatom yang berbeda. Semua atom dalam suatu unsur yang sama memiliki jumlah proton yang sama di dalam intinya. Jumlah proton
ini unik untuk setiap unsur dan dijadikan
sebagai dasar nomor atom. Sementara nomor massa suatu atom ditentukan oleh
jumlah neutron dan proton. Atom yang satu berbeda dengan atom yang lain karena
mempunyai jumlah elektron, proton, dan neutron yang berbeda.
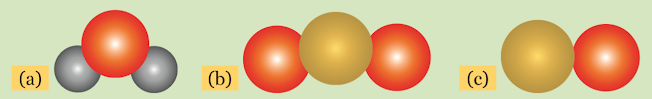 |
| Gambar Model Molekul Dalton untuk (a) Air (H2O), (b) Karbon Dioksida (CO2), (c) Karbon Monoksida (CO) |
Jika dua atom mempunyai massa atom berbeda, maka jari-jari kedua atom itu akan berbeda pula. Oleh sebab itu, pada Gambar di atas, atom H, O, dan C mempunyai ukuran yang berbeda.
Hubungan nomor atom, nomor massa, dan jumlah neutron dalam suatu atom yang netral (tidak bermuatan) dapat dituliskan dengan persamaan berikut.
Nomor
atom = Jumlah proton (p) = jumlah elektron (e)
Nomor massa = Jumlah proton (p) + Jumlah neutron (n)
Setiap unsur dituliskan dengan lambang unsur.
Pada penulisan lambang unsur, nomor atom ditulis sebagai subscript (turun) di
kiri lambang unsur, sedangkan nomor massa ditulis sebagai superscript (naik) di
kiri atas lambang unsur, sebagaimana berikut.
Sebagai contoh, penulisan lambang unsur litium (Li) yang mempunyai nomor atom 3 dan nomor massa 7 adalah
Agar kamu dapat lebih memahami penulisan
lambang atom, menentukan nomor massa, jumlah proton, serta jumlah elektronnya pelajari
tabel dibawah!
Sebagian besar unsur yang ada di alam sangat penting untuk kehidupan. Namun, ada beberapa unsur yang disebut logam berat, berbahaya bagi tubuh manusia dan lingkungan. Unsur ini tidak dapat didaur ulang dalam tubuh dan sulit untuk dikeluarkan, karena dalam tubuh kita tidak ada mekanisme yang berfungsi untuk menghilangkan unsur ini. Logam berat mampu bertahan dalam tubuh sepanjang hayat kita. Konsentrasi logam berat dalam tubuh dapat bertambah sepanjang waktu atau dikenal dengan bioakumulasi. Logam berat dapat menyebabkan berbagai penyakit, seperti kanker dan bahkan dapat menyebabkan kematian. Seorang wanita yang hamil juga dapat mengalami keguguran dan melahirkan bayi yang cacat akibat kandungan logam berat yang cukup tinggi dalam tubuhnya.
Pernahkah kamu mendengar musibah Minamata? Gejala Minamata pertama kali diidentifikasi pada tahun 1956 di teluk Minamata, Jepang. Di teluk Minamata ini terdapat pelabuhan ikan, pabrik pupuk, dan senyawa kimia lain yang dalam prosesnya menggunakan merkuri (Hg). Suatu ketika merkuri ini bocor dan masuk ke dalam lautan sehingga mengontaminasi ikan dan hewan laut lainnya. Masyarakat sekitar yang mengkonsumsi ikan yang terkontaminasi merkuri mengalami bioakumulasi merkuri dalam tubuhnya. Bioakumulasi merkuri ini menyebabkan keterbelakangan mental, cacat lahir, buta dan tuli, serta menyebabkan kematian.
Kejadian musibah Minamata membuat perhatian
warga dunia untuk lebih menjaga lingkungan dari pencemaran, khususnya
pencemaran logam berat. Teluk Minamata akhirnya ditetapkan bebas merkuri pada
bulan Juli 1997 (41 tahun kemudian) dan warga sekitar dapat beraktivitas secara
normal baik untuk menangkap ikan maupun berenang di laut.
Referensi:
Ilmu Pengetahuan Alam. SMP/MTs Kelas IX Semester 2. Kementerian Pendidikan dan Kebudayaan. Edisi Revisi Jakarta: Kementerian Pendidikan dan Kebudayaan, 2017
Baca juga:
Partikel Penyusun Benda dan Makhluk Hidup | |
01 | |
02 | |
03 | Mengidentifikasi Perbedaan Zat dalam Benda dan Makhluk Hidup |
04 | |
05 | |
06 | |
07 | |
08 | |
09 | |
10 | |
11 | |
12 | |
13 | |
14 | |
15 | |
16 | |
17 | Sifat Zat dan Hubungannya dengan Partikel Penyusun dan Strukturnya |
18 | |
19 | |
20 | |


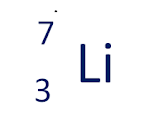


Tidak ada komentar:
Posting Komentar