Zat merupakan materi yang susunan unsur-unsurnya tidak berubah-ubah. Ada banyak sekali zat yang ada di bumi ini. Untuk mempermudah dalam mempelajarinya, zat diklasifikasikan berdasarkan kriteria tertentu.
Zat meliputi zat murni dan campuran. Zat murni dapat berupa unsur dan senyawa. Sedangkan campuran dapat berupa campuran homogen dan campuran heterogen.
Zat juga dapat diklasifikasikan berdasarkan derajat keasamannya, yaitu menjadi asam, basa, dan garam.
1. Asam
 |
| Contoh makanan mengandung Asam |
Secara kimia, asam adalah zat yang dalam air dapat menghasilkan ion hidrogen (H+). Asam akan terionisasi menjadi ion hidrogen dan ion sisa asam yang bermuatan negatif.
Beberapa asam yang dikenal

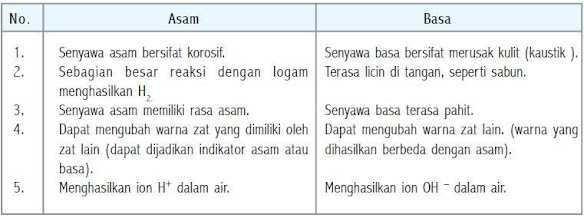
Sifat-sifat larutan asam adalah sebagai berikut:
(a) Rasanya masam.
(b) Menghantarkan arus listrik.
(c) Jika dilarutkan akan melepaskan ion hidrogen (H+).
(d) Mengubah lakmus biru menjadi merah.
(e) Bersifat korosif terhadap logam.
2. Basa
 |
| Contoh bahan mengandung Basa |
Basa adalah zat yang dalam air dapat menghasilkan ion hidroksida (OH–). Ion hidroksida terbentuk karena senyawa hidroksida dapat mengikat satu elektron pada saat dimasukkan ke dalam air. Basa dapat menetralisir asam (H+) sehingga dihasilkan air (H2O). Sabun merupakan salah satu zat yang bersifat basa.
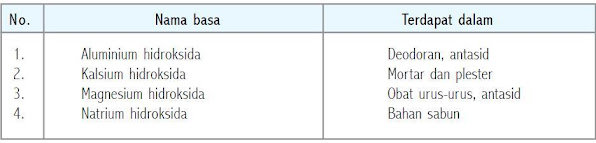
Beberapa basa yang dikenal
Sifat-sifat larutan basa adalah sebagai berikut:
(a) Terasa licin jika terkena kulit.
(b) Menghantarkan arus listrik.
(c) Jika dilarutkan dalam air akan melepaskan ion hidroksida atau OH.
(d) Mengubah lakmus merah menjadi biru.
(e) Menetralkan larutan asam.
Perbedaan sifat asam dan basa
3. Garam
 |
| Contoh "Garam" |
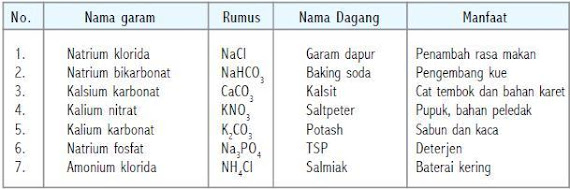
Garam adalah senyawa yang terbentuk dari reaksi asam dan basa. Terdapat beberapa contoh garam, antara lain: NaCl, CaCl2, ZnSO4, NaNO2, dan lain-lain.
Dalam kehidupan sehari–hari tentu kamu tidak asing dengan garam. Contoh garam adalah garam dapur (NaCl) yang biasa digunakan untuk keperluan memasak. Garam dapur dapat diperoleh dari air laut. Petani garam membuatnya dengan cara penguapan dan kristalisasi. Garam yang diperoleh kemudian diproses iodisasi (garam kalium, KI) sehingga diperoleh garam beriodium.
Garam dapur juga dapat diperoleh dengan cara mencampur zat asam dan basa. Asam bereaksi dengan basa membentuk zat netral dan tidak bersifat asam maupun basa. Reaksi antara asam dan basa dinamakan reaksi netralisasi. Sebagai contoh asam klorida bereaksi dengan natrium hidroksida (soda api) akan membentuk garam dapur dan air.
Jika dengan menggunakan proses penguapan, maka air akan menguap dan tersisa endapan garam dapur saja.
HCl + NaOH → NaCl + H2O
Asam Basa Garam dapur Air
Reaksi kimia yang dapat menghasilkan garam, antara lain:
1) Asam + basa menghasilkan garam + air
2) Basa + oksida asam menghasilkan garam + air
3) Asam + oksida basa menghasilkan garam + air
4) Oksida asam + oksida basa menghasilkan garam
5) Logam + asam menghasilkan garam + H2
Beberapa garam yang dikenal
Reaksi penetralan berguna bagi manusia, antara lain produksi asam lambung (HCl) yang berlebihan dapat dinetralkan dengan menggunakan senyawa basa Mg(OH)2.
Para petani menggunakan reaksi penetralan agar tanah yang terlalu asam dan tidak baik bagi tanaman dapat menjadi netral dengan menambahkan senyawa basa Ca(OH)2 atau air kapur.
Pasta gigi mengandung basa berfungsi untuk menetralkan mulut kita dari asam, yang dapat merusak gigi dan menimbulkan bau mulut.
4. Identifikasi Asam, Basa, dan Senyawa
Berdasarkan sifat asam dan basa, larutan dibedakan menjadi tiga golongan yaitu : bersifat asam, basa, dan netral. Sifat larutan tersebut dapat ditunjukkan dengan menggunakan indikator asam-basa, yaitu zat-zat warna yang menghasilkan warna berbeda dalam larutan asam dan basa.
Cara menentukan senyawa bersifat asam, basa atau netral dapat menggunakan kertas lakmus, larutan indikator atau larutan alami. Misal, lakmus merah dan biru.
Indikator asam–basa dalam larutan yang bersifat asam, basa dan netral.
Lakmus digunakan sebagai indikator asam-basa, sebab lakmus memiliki beberapa keuntungan, yaitu:
(1) Lakmus dapat berubah warna dengan cepat saat bereaksi dengan asam ataupun basa.
(2) Lakmus sukar bereaksi dengan oksigen dalam udara sehingga dapat tahan lama.
(3) Lakmus mudah diserap oleh kertas, sehingga digunakan dalam bentuk lakmus kertas. Lakmus adalah sejenis zat yang diperoleh dari jenis lumut kerak.
Selain menggunakan indikator buatan, dipakai pula indikator alami untuk mengelompokkan bahan-bahan di lingkungan berdasarkan konsep asam, basa, dan garam. Indikator alami, seperti : bunga sepatu, kunyit, kulit manggis, kubis ungu atau jenis bunga-bungaan yang berwarna. Ekstrak bahan-bahan tersebut dapat memberikan warna yang berbeda dalam larutan asam dan basa.
Penyusun
Nama : Lu’luil Maknun
Nama : Lu’luil Maknun
Kelas : 9i
Tahun : 2011
Sumber :
Smp7ipa IPA Teguh Sugiarto, Eny Ismawati
Smp7ipa IPA Wasis, Sugeng Yuli Irianto
Baca berikutnya ...
PENERAPAN KIMIA DALAM KEHIDUPAN | |
01 | |
02 | |
03 | |
04 | |
05 | |
06 | |
07 | |
08 | |
09 | |
sya copy njih dik, semoga tulisannya bermanfaat
BalasHapusSilahkan, terima kasih bila ada manfaatnya, saya percaya Lu’luil Maknun yang menyusun tidak keberatan.
BalasHapus