A. Partikel Materi
Kita tahu bahwa segala materi di sekeliling kita, baik yang berupa zat tunggal maupun campuran, terdiri atas butir-butir kecil atau partikel. Zat tunggal terdiri atas sejenis partikel, sedangkan campuran terdiri atas dua atau lebih jenis partikel yang tercampur begitu saja tanpa reaksi kimia.
Partikel materi dapat berupa atom, molekul, atau ion. Partikel materi tersebut mempunyai ukuran sangat kecil, sehingga hampir mustahil untuk mengamatinya. Namun, berkat kemajuan sains dan teknologi, saat ini telah berhasil ditemukan partikel paling kecil yang disebut quark atau dalam bahasa Indonesia disebut sebagai kuark.
Anggapan bahwa atom merupakan bola kecil yang kompak dan tidak dapat dipecahkan lagi menjadi partikel yang lebih sederhana ternyata tidak benar. Penemuan keradioaktifan oleh Antonie Henri Becquerel ratusan tahun yang lalu telah membuktikan bahwa atom tersusun atas partikel-partikel yang lebih kecil lagi, yaitu elektron (ditemukan oleh Joseph John Thomson), proton (ditemukan oleh Ernest Rutherford), dan neutron (ditemukan oleh James Chadwick).
Satu atom, menurut ilmu kimia, terstruktur atas inti atom yang terdiri atas proton (bermuatan positif) dan neutron (netral), serta elektron yang bermuatan negatif dan beredar mengelilingi inti dalam lintasan-lintasan tertentu yang disebut kulit dan orbital atom. Jumlah proton = jumlah elektron (karena atom bersifat netral) menunjukkan nomor atom. Jumlah proton atau elektron + neutron menunjukkan bobot atom.
B. Apakah Atom dapat Dilihat?
 |
| Visualisasi Atom |
Kita patut bersyukur kepada Tuhan bahwa berkat kemajuan teknologi, saat ini telah dapat dilakukan visualisasi partikel materi yang pernah dianggap sebagai partikel terkecil, yaitu atom.
Visualisasi atom dilakukan dengan menggunakan sebuah mikroskop yang dikenal sebagai STM atau Scanning Tunneling Microscope. Melalui monitor komputer dapat dilihat visualisasi terhadap atom-atom yang diamati melalui STM.
Atom-atom silikon-60 pada gambar di atas yang mula-mula terlihat sebagai bintik putih pada gambar sebelah kiri dapat terlihat secara individual di dalam gambar terkomputerisasi yang diperoleh dengan menggunakan mikroskop STM (Scanning Tunneling Microscope) pada gambar sebelah kanan. Mikroskop ini mampu memperbesar citra permukaan yang berskala atomik dengan cara mendeteksi aliran listrik yang mengalir dari permukaan tersebut menuju ujung logam pendeteksi.
Sedemikian kecilnya sebuah atom hingga beberapa gram unsur atau senyawa dapat terdiri atas miliaran triliun atom. Misalnya, 58,5 gram Kristal garam yang terdiri atas kurang lebih 600.000.000.000.000.000.000.000 (enam ratus miliar triliun) atom.
C. Atom
 |
| Ilmuwan Peneliti Atom |
Alam semesta, termasuk tumbuhan, hewan, dan manusia sesungguhnya tersusun atas ratusan ribu hingga jutaan jenis materi. Materi-materi itu, jika diuraikan akan merupakan kombinasi dari atom atom.
Democritus, seorang filsuf asal Yunani pada abad IV SM, adalah pencetus gagasan tentang atom pertama kali. Pada masa itu ada dua pendapat mengenai pembagian materi. Menurut Democritus, pembagian materi bersifat diskontinu. Artinya, jika suatu materi dibagi dan dibagi lagi maka akhirnya diperoleh partikel terkecil yang sudah tak dapat dibagi lagi. Partikel terkecil itu disebut atom, yang dalam bahasa Yunani berarti tak terbagi (a = tidak; tomos = terbagi).
Pendapat lain dikemukakan oleh Aristoteles yang mengatakan bahwa pembagian materi bersifat kontinu, artinya pembagian dapat berlanjut tanpa batas.
Pada tahun 1803, John Dalton, seorang ahli dalam bidang fisika dan kimia mengajukan suatu teori yang menegaskan bahwa materi terdiri atas atom. Jadi, atom adalah bagian terkecil dari unsur. Atom bersifat netral (tidak bermuatan listrik).
Teori atom Dalton meliputi empat hal sebagai berikut:
(1) Seluruh materi tersusun oleh partikel terkecil yang disebut atom.
(2) Atom tidak dapat dibuat, dipecah, atau dibagi menjadi bagian kecil lainnya.
(3) Atom unsur yang sama memiliki sifat dan massa yang sama.
(4) Atom unsur yang berbeda memiliki sifat dan massa yang berbeda.
 |
| Model Atom |
Pada tahap berikutnya, model atom benar-benar berkembang sampai pada konsep paling modern yang berlaku hingga saat ini bahwa atom adalah materi yang sekaligus bersifat gelombang seperti yang diungkapkan oleh de Broglie.
Atom memiliki diameter 10-8 (0,00000001) cm, terdiri atas inti atom dan dikelilingi oleh elektron yang bergerak menurut orbit tertentu. Hampir semua massa atom terpusat di inti atom yang berupa proton dan neutron, sementara jari-jari inti atom yang besarnya 10-13 cm jika dibandingkan dengan jari-jari atom itu sendiri adalah 1: 100.000. Apabila kita misalkan inti atom adalah kelereng yang diameternya 1 cm maka kulit atom jaraknya akan menjadi 100.000 cm atau 1 km dari kelereng tersebut. Jadi, kita dapat membayangkan betapa berongganya atom yang kita kira pejal tersebut.
D. Partikel-partikel Subatom
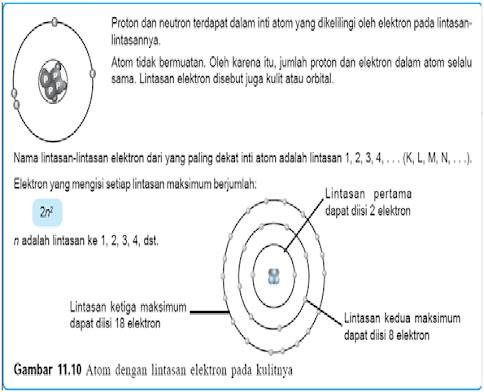 |
| Inti Atom dan Elektron |
1. Proton
Proton adalah partikel bermuatan positif yang terdapat di dalam inti atom. Proton dilambangkan dengan huruf p dan massanya adalah 1 sma (satuan massa atom). Muatan sebuah proton adalah +1 yang juga sebanding dengan 1,602 . 10-19 coulomb. Setiap unsur memiliki atom-atom tertentu dengan jumlah proton yang tidak sama. Misalnya, hidrogen jumlah protonnya adalah satu, lithium jumlah protonnya adalah tiga, natrium sebelas, dan sebagainya.
2. Neutron
Kata neutron berasal dari bahasa Latin neutral yang berarti tidak memiliki muatan. Lambang untuk neutron adalah n. Massa neutron setara dengan 1 sma (satuan massa atom). Sebagai contoh, helium memiliki neutron sebanyak 2, lithium memiliki neutron sebanyak 3, natrium memiliki neutron sebanyak 11, dan sebagainya.
3. Elektron
Partikel penyusun dengan massa paling ringan adalah elektron. Massa elektron hanya 1/1840 sma (satu per seribu delapan ratus empat puluh sma). Oleh karena itu, elektron dianggap tidak bermassa. Elektron memiliki muatan negatif yang setara dengan 1,602 .10-19 C.
E. Molekul
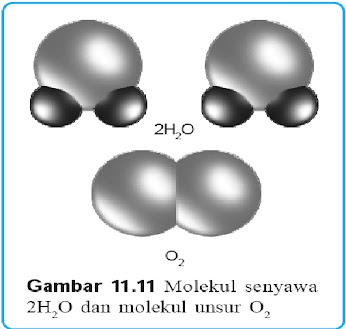 |
| Molekul Senyawa dan Molekul Unsur |
Molekul adalah partikel netral yang terdiri atas dua atau lebih atom, baik atom sejenis maupun atom yang berbeda. Ada 2 jenis molekul, yaitu molekul monoatomik dan molekul poliatomik. Molekul monoatomik adalah molekul yang terdiri atas satu atom, misalnya molekul gas mulia (He, Ne, Ar, Kr, Xe, dan Rn). Sedangkan molekul poliatomik adalah molekul yang terdiri atas lebih dari 1 atom. Molekul poliatomik yang terdiri atas atom sejenis disebut molekul unsur, sedangkan yang terdiri atas atom-atom yang berbeda disebut molekul senyawa. Molekul-molekul unsur dapat berupa diatomik seperti O2, N2, dan Cl2, atau tetraatomik seperti P4, dapat juga berupa oktaatomik seperti S8. Dalam kehidupan sehari-hari, tanpa kita sadari kita sering menggunakan molekul unsur dan molekul senyawa tertentu.
F. Ion
 |
| Ion |
Ion adalah atom atau gugus atom yang bermuatan listrik. Ion terdiri atas kation dan anion. Kation adalah ion yang bermuatan positif, sedangkan anion adalah ion yang bermuatan negatif. Kation dan anion bergabung dalam proporsi yang tertentu dan tetap untuk membentuk senyawa ionik yang netral.
Garam dapur (natrium klorida) merupakan contoh bergabungnya kation Na+ dengan anion Cl–. Senyawa yang terbentuk dari ion-ion disebut sebagai senyawa ionik. Kation dan anion bergabung dengan perbandingan tertentu untuk menghasilkan senyawa ionik yang netral. Agar dapat dihasilkan senyawa ionik yang netral, muatan negative pada anion jumlahnya harus sama dengan muatan positif pada kation.
Sumber:
H. Moch. Agus Krisno, dkk. 2008. bse IPA kelas 8. Jakarta: Pusat Perbukuan , Departemen Pendidikan Nasional
Disusun oleh:
Nama :Siti Maria Ulfah
Kelas :IX H
Sekolah:SMP Negeri 1 Adiwerna
Tahun Ajaran:2011-2012
Baca berikutnya ...
1 komentar:
Terima kasih
Posting Komentar