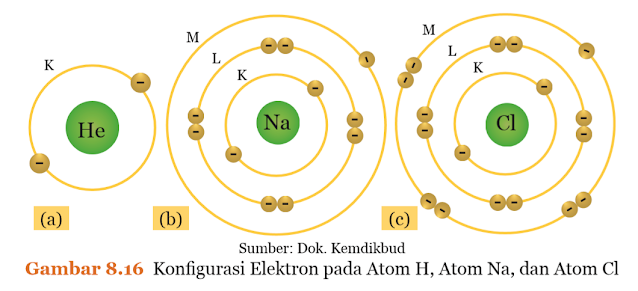
Atom-atom dengan nomor atom 1 sampai 18 akan
berada dalam keadaan stabil bila kulit atom terluarnya berisi 2 elektron
seperti helium (He) atau 8 elektron
seperti neon (Ne), argon (Ar), dan kripton (Kr). Agar dapat mencapai jumlah 8 elektron
pada kulit terluarnya, suatu atom dapat melepaskan atau menerima satu atau
lebih elektron. Contoh atom natrium (Na)
yang mempunyai 11 elektron mempunyai susunan elektron K=2, L=8, dan M=1
(perhatikan kembali Gambar 8.16b). Pada konfigurasi seperti ini kulit atom M
dalam atom Na hanya terisi satu elektron. Keadaan ini menyebabkan atom Na tidak
stabil.
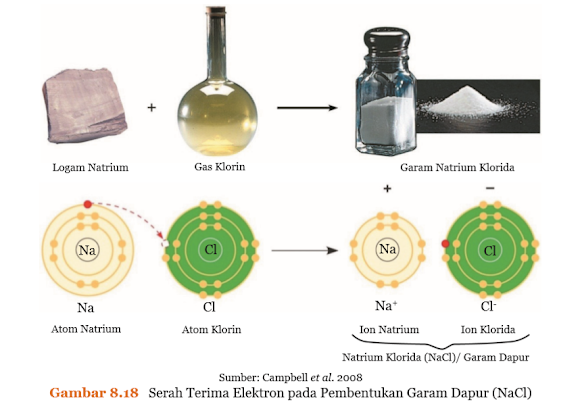
Agar mempunyai 8 elektron pada kulit terluarnya, atom Na dapat melepaskan satu elektron dari kulit M tersebut atau menerima 7 elektron dari atom lain. Menerima 7 elektron sangatlah sulit, maka dari itu, atom natrium (Na) cenderung melepaskan 1 elektron. Akibatnya, bila atom Na melepaskan satu elektron, maka di dalam inti atom Na ada 11 proton yang bermuatan positif sedangkan pada kulit atom tinggal 10 elektron yang bermuatan negatif, sehingga secara keseluruhan atom Na bermuatan satu positif (+1).
Jadi, atom natrium (Na) yang pada mulanya bersifat netral, setelah melepaskan satu elektron akan berubah menjadi Na yang bermuatan +1, dan ditulis Na+ yang disebut dengan ion Na+. Berdasarkan penjelasan tersebut, apakah kamu dapat menyimpulkan apa itu ion? Ion yang bermuatan positif seperti ion Na+ secara umum disebut kation. Contoh lain adalah atom kalisum (Ca) yang mempunyai susunan elektron dalam atomnya K = 2, L = 8, M = 8, dan N = 2. Agar mempunyai 8 elektron pada kulit terluar maka kalisum (Ca) cenderung melepaskan dua elektron dari kulit N, sehingga menjadi ion Ca2+.
Sebaliknya, atom klorin (Cl) mempunyai susunan elektron K = 2, L = 8, dan M = 7 (perhatikan Gambar 8.16c). Agar atom klorin (Cl) stabil, maka ditangkaplah satu elektron dari atom lain agar kulit atom M terisi oleh 8 elektron. Atom klorin (Cl) yang menerima satu elektron akan kelebihan muatan negatif. Atom klorin (Cl) yang pada mulanya bersifat netral dengan 17 proton dan 17 elektron, jika menerima satu elektron dari luar maka akan menjadi bermuatan -1 atau ditulis Cl–. Ion yang bermuatan negatif secara umum disebut anion.
Sebuah ion positif (kation) memiliki jumlah
elektron lebih sedikit dibandingkan proton yang ada pada inti atom tersebut.
Sebaliknya, ion negatif (anion) memiliki jumlah elektron lebih banyak
dibandingkan protonnya. Dengan kata lain, atom yang
melepaskan elektron akan menjadi ion yang bermuatan positif, sedangkan atom yang
menerima elektron akan menjadi ion yang bermuatan negatif. Perhatikan
Gambar 8.18!
Pada NaCl, kation dan anion tersusun
selang-seling secara teratur sedemikian rupa seperti pada Gambar 8.19 sehingga
interaksi tarik-menarik antara ion Na+ dan ion Cl–
terjadi secara maksimal. Susunan seperti itu disebut dengan istilah kristal.
Umumnya unsur-unsur logam cenderung melepaskan elektron, sehingga akan membentuk kation. Sebaliknya unsur nonlogam akan cenderung menerima elektron sehingga membentuk anion. Kecenderungan suatu atom untuk menerima atau melepas elektron sehingga menjadi stabil juga dapat diketahui dari jumlah elektron terluar. Atom yang memiliki elektron terluar lebih dari 5 pada kulit terluarnya cenderung menerima elektron, sedangkan atom yang memiliki elektron kurang dari 4 pada kulit terluarnya cenderung melepaskan elektron.
Di dalam tubuh kita terdapat banyak sekali ion, antara lain ion kalium (K+), ion kalsium (Ca2+), ion magnesium (Mg2+), ion klorida (Cl-), ion karbonat (CO32–), dan ion hidrogen karbonat (HCO3–). Coba bandingkan kandungan ion-ion yang terkandung dalam minuman penyegar dengan ion-ion yang ada dalam tubuh!
Ketika kamu melakukan aktivitas yang berat, seperti berlari atau bermain sepak bola, ion-ion yang ada dalam tubuh akan dikeluarkan bersama keringat. Kejadian ini mengakibatkan ion-ion dalam tubuh berkurang sehingga tubuhmu terasa lelah. Ion-ion dalam tubuh yang keluar bersama keringat dapat digantikan dari makanan dan minuman yang kita konsumsi. Dengan mendapat asupan ion-ion dari makanan dan minuman, tubuhmu akan menjadi segar kembali.
Tahukah kamu, agar
atom-atom dapat berada dalam keadaan stabil, atom-atom juga dapat menggunakan
sejumlah elektron secara bersama. Contoh paling sederhana adalah atom
hidrogen (H) yang mempunyai satu elektron. Hidrogen di alam bukan sebagai atom
H, tetapi merupakan molekul H2. Molekul H2 mempunyai dua
elektron yang digunakan bersama sehingga setiap atom H dalam molekul H2
akan mampunyai dua elektron. Keadaan ini menyerupai elektron terluar pada gas
mulia helium (He). Perhatikan Gambar 8.20!
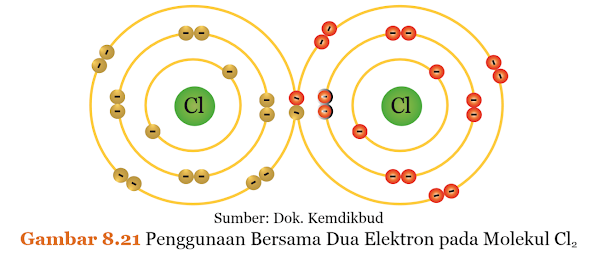
Peristiwa serupa juga terjadi pada atom klorin (Cl) yang mempunyai 7 elektron pada kulit atom M, sehingga untuk menjadi lebih stabil masih kekurangan satu elektron. Agar dapat melengkapi jumlah elektron pada kulit terluarnya (menjadi 8), atom Cl menggunakan bersama satu elektron dari atom Cl lain sehingga membentuk Cl2 seperti pada Gambar 8.21.
Pembentukan ikatan kimia melalui penggunaan bersama elektron oleh dua atom disebut ikatan kovalen. Pada contoh gas hidrogen dan gas klorin di atas, masing-masing atom menggunakan secara bersama satu pasang elektron. Ikatan yang terbentuk antara atom H dengan atom H atau atom Cl dengan atom Cl biasanya ditulis dengan lambang H—H atau Cl—Cl. Satu tanda garis ‘—‘ mewakili satu pasang elektron yang digunakan secara bersama.
Unsur oksigen (O) dan nitrogen (N) di alam
terdapat sebagai gas O2 dan N2. Bagaimana gas oksigen (O2)
dan gas nitrogen (N2) terbentuk? Agar lebih stabil atom O memerlukan
2 elektron agar kulit terluarnya terisi 8 elektron. Agar dapat memenuhi keadaan
itu atom O menggunakan bersama dua pasang elektron seperti pada Gambar 8.22a.
Atom nitrogen mempunyai 5 elektron pada kulit terluarnya sehingga kekurangan 3
elektron. Oleh sebab itu, atom N akan berikatan dengan atom N yang lain
menggunakan bersama 3 pasangan elektron (Gambar 8.22b). Ikatan kovalen pada gas
oksigen dapat ditulis dengan O=O
sedangkan pada gas nitrogen dapat ditulis N≡N. Ingat! Banyaknya garis yang menghubungkan
kedua atom tersebut menunjukkan banyaknya pasangan elektron yang digunakan
bersama.
Masih ingatkah kamu model atom Dalton untuk senyawa H2O dan CO2? Pada molekul air (H2O), satu atom oksigen mengikat dua atom hidrogen. Air merupakan senyawa di mana atom-atomnya berikatan secara kovalen. Demikian juga gas CO2, satu atom C mengikat dua atom O dan kedua atom ini menggunakan bersama pasangan elektron. Senyawa-senyawa yang antar atomnya berikatan kovalen disebut senyawa kovalen.
Pencapaian kestabilan atom-atom suatu unsur yang ada di alam dilakukan dengan cara melepaskan dan menerima elektron atau menggunakan secara bersama pasangan elektron. Peristiwa ini menyebabkan atom-atom dapat bergabung satu sama lain membentuk molekul. Oleh karena itu, molekul-molekul glukosa yang terdiri atas atom-atom C, H, dan O bergabung membentuk senyawa C6H12O6 yang rasanya manis. Pada Gambar 8.4 kamu telah ditunjukkan bahwa molekul-molekul glukosa bergabung satu dengan yang lain membentuk rantai panjang menghasilkan molekul rantai panjang penyusun amilum.
Referensi:
Ilmu Pengetahuan Alam. SMP/MTs Kelas IX Semester 2. Kementerian
Pendidikan dan Kebudayaan. Edisi Revisi Jakarta: Kementerian Pendidikan dan
Kebudayaan, 2017
Baca juga:
Partikel Penyusun Benda dan Makhluk Hidup | |
01 | |
02 | |
03 | Mengidentifikasi Perbedaan Zat dalam Benda dan Makhluk Hidup |
04 | |
05 | |
06 | |
07 | |
08 | |
09 | |
10 | |
11 | |
12 | |
13 | |
14 | |
15 | |
16 | |
17 | Sifat Zat dan Hubungannya dengan Partikel Penyusun dan Strukturnya |
18 | |
19 | |
20 | |