I. Elemen Primer
Elemen Primer tidak dapat digunakan terus-menerus, antara lain:
A. Elemen Volta:
 |
| Elemen Volta |
1. Penemu: Alessandro Volta (1745-1827)
2. Elektroda positif (kutub positif/ anoda) : lempeng tembaga (Cu).
3. Elektroda negatif (kutub negatif/katoda): lempeng seng (Zn)
4. Larutan Elektrolit (penghantar arus listrik): Asam Sulfat (H2SO4)
5. Arus Listrik: dari tembaga menuju seng
6. Arus Elektron: dari seng menuju tembaga
7. Kelemahan: terjadi polarisasi, menempelnya gelembung gas pada tembaga.
8. Beda Potensial yang dihasilkan: 1 volt.
B. Elemen Leclanche
 |
| Elemen Leclanche |
1. Penemu: Leclanche
2. Elektroda Positif : batang karbon ( C )
3. Elektroda negatif : seng ( Zn )
4. Larutan Elektrolit: Amonium Klorida ( NH4Cl )
5. Arus Listrik: dari karbon menuju seng
6. Depolarisator (menghindari polarisasi): Mangan dioksida (MnO2)
7. Beda Potensial yang dihasilkan: 1,5 volt
C. Elemen Daniell
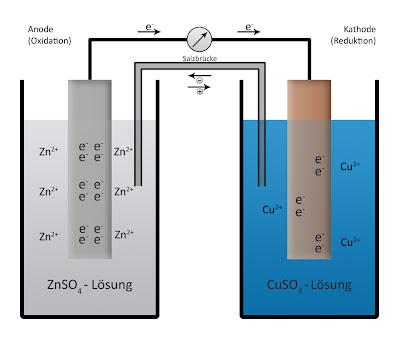 |
| Elemen Daniell |
1. Penemu: John Daniell ( 1790-1845 )
2. Elektroda Positif : silinder tembaga ( Cu ) dalam larutan sulfat tembaga ( CuSO4 )
3. Elektroda negatif : batang seng ( Zn ) dalam larutan seng sulfat ( ZnSO4 )
4. Arus Listrik: dari tembaga menuju seng
5. Beda Potensial yang dihasilkan: 1,1 volt
D. Elemen Kering (batu baterai)
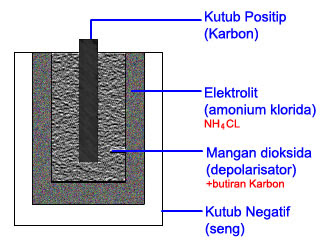 |
| Elemen Kering atau batu baterai |
1. Penemu: Alessandro Volta
2. Elektroda Positif : batang karbon ( C ), letak ditengah, bagian atas ditutup kuningan.
3. Elektroda negatif : seng ( Zn ), dibagian luar
4. Larutan Elektrolit: Amonium Klorida ( NH4Cl )
5. Arus Listrik: dari karbon menuju seng
6. Depolarisator: Mangan Dioksida ( MnO2 )
7. Beda Potensial yang dihasilkan: 1,5 volt
II. Elemen Sekunder
Elemen Sekunder dapat digunakan terus-menerus dengan diisi ulang, antara lain:
A. Aki (Akumulator)
 |
| Aki (Akumulator) |
1. Kutub Positif: lempeng timbal dioksida (PbO2)
2. Kutub Negatif: lempeng timbal (Pb)
3. Larutan Elektrolit: asam sulfat (H2SO4)
4. Aki digunakan: timbal (-) dan timbal dioksida (+) bereaksi dengan asam sulfat menjadi timbal sulfat.
5. Aki diisi: timbal sulfat berubah menjadi timbal (-) dan timbal dioksida ( + ).
6. Beda potensial yang dihasilkan: 2 volt tiap satu pasang sel.
B. Baterai Isi Ulang
(1) Baterai isi ulang Nikel-Kadmium (Ni-Cd)
 |
| Baterai isi ulang Nikel-Kadmium (Ni-Cd) |
1. Kutub positif: Nikel Hidroksida (Ni(OH)2)
2. Kutub negatif: Kadmium Hidroksida ( Cd (OH)2 )
3. Larutan Elektrolit: Potasium Hidroksida ( KOH )
4. Arus Listrik: dari Nikel Hidroksida ke Kadmium Hidroksida.
5. Beda Potensial yang dihasilkan: 1,25 volt
6. Digunakan pada: kamera digital, radio, laptop,bor listrik.
(2) Baterai isi ulang Nikel-Metal Hidrat ( Ni-MH )
 |
| Baterai isi ulang Nikel-Metal Hidrat (Ni-MH) |
1. Kutub positif: Metal Hidrat ( MH )
2. Kutub negatif: Nikel Oksi Hidroksida ( Ni O (OH) )
3. Larutan Elektrolit: Potasium Hidroksida ( KOH )
4. Arus Listrik: dari Metal Hidrat ke Nikel Oksi Hidroksida.
5. Beda Potensial yang dihasilkan: 1,4 volt
6. Digunakan pada: HP, kamera digital, laptop,bor listrik.
(3) Baterai isi ulang Lithium-Ion
 |
| Baterai isi ulang Lithium-Ion |
2. Kutub negative: lithium ( Li )
3. Larutan Elektrolit: Lithium Perklorat ( Li Cl O4 )
4. Arus Listrik: dari Lithium-Metal Oksida ke lithium ( Li )
5. Beda Potensial yang dihasilkan: 3.7 volt
6. Digunakan pada: HP, radio, laptop.
Sumber: (1) Budi Prasodjo, dkk.2007. IPA Terpadu 3A. Bogor: Yudhistira. (2) Gambar dari Google Images.
Baca juga ...
Baca juga ...
MAGNET, LISTRIK, DAN ELEKTROMAGNETIK | |
01 | |
02 | |
03 | |
04 | |
05 | |
06 | |
07 | |
08 | |
09 | |
Tidak ada komentar:
Posting Komentar